Expresión génica y regulación metabólica en cianobacterias
Francisco J. Florencio y M. Isabel Muro-PastorEl interés científico del grupo se centra en elucidar las estrategias adaptativas de las cianobacterias a los cambios en las condiciones ambientales, especialmente aquellas relacionadas con la eficiencia fotosintética (irradiancia lumínica), la disponibilidad de nutrientes (carbono y nitrógeno) y los cambios en el estado redox celular. Para ello utilizamos principalmente la cianobacteria unicelular Synechocystis sp. PCC 6803, considerada un organismo modelo para estudios de fotosíntesis y metabolismo del carbono, debido a su plasticidad metabólica y un conocimiento profundo de su genoma.
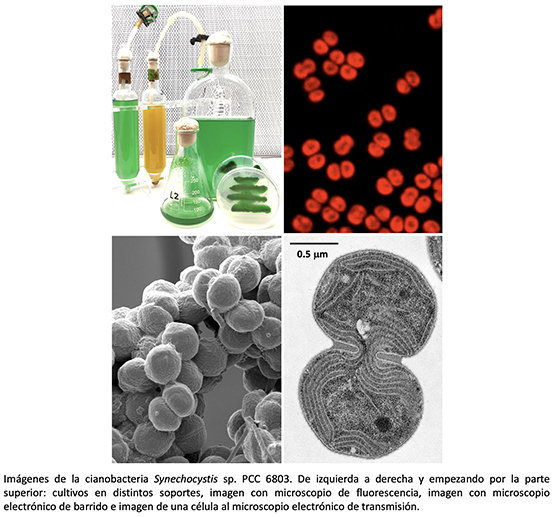
Actualmente tenemos varias líneas de investigación:
1. Regulación del metabolismo central del carbono.
Analizamos distintos mutantes que alteran el flujo de carbono celular, ya sea eliminando alguna ruta metabólica, como es el caso de la síntesis y degradación del glucógeno, o modificando la capacidad para regular el propio flujo, como es el caso del factor CfrA. El abordaje experimental comprende análisis metabolómicos, cuantificando compuestos del metabolismo central del carbono (Ciclo de Calvin, Glucólisis, Ciclo de Krebs y síntesis de aminoácidos), ensayos enzimáticos y expresión de genes relacionados con dichos procesos. Se pretende construir un modelo que se ajuste a los cambios tanto en la iluminación, como a distintos niveles de CO2 y a la disponibilidad de nitrógeno en el medio, para identificar los conectores de las distintas señales y como se produce la integración entre ellas. Como corolario a todos estos estudios estamos analizando el potencial biotecnológico de los distintos mutantes para producir compuestos de carbono, como sacarosa y lactato, con una alta eficiencia al poder dirigir controladamente el flujo de carbono celular.
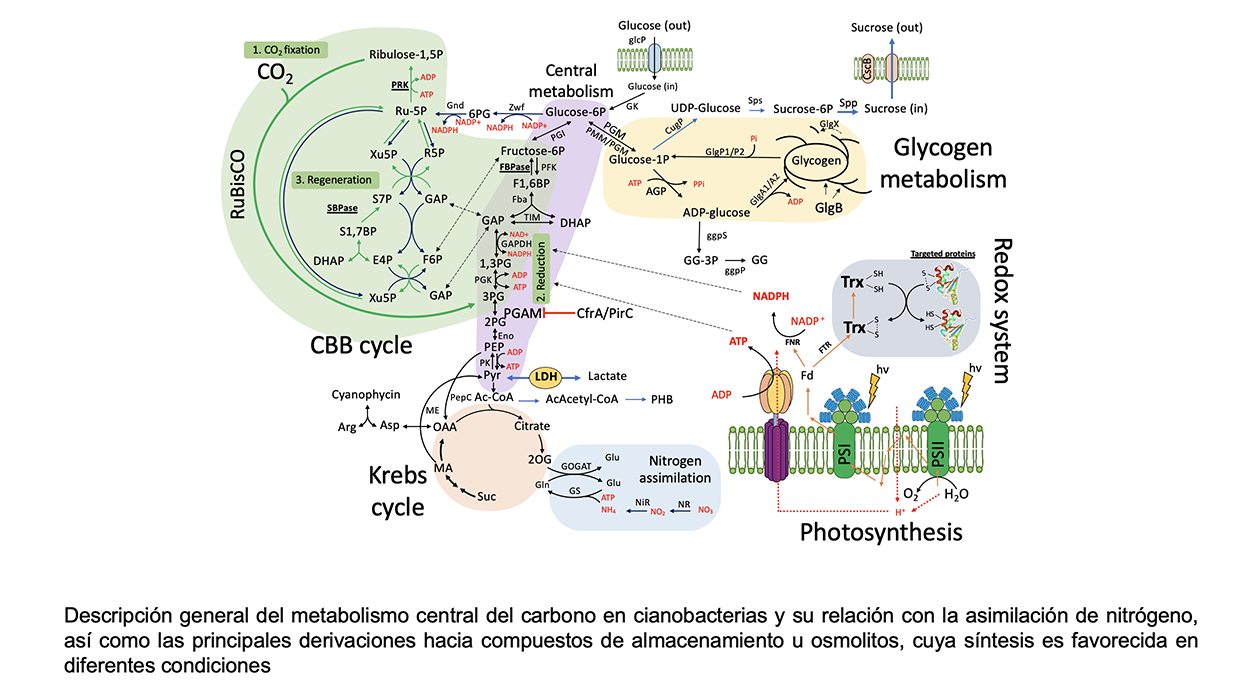
2. Dinámica del metabolismo del glucógeno.
Utilizando distintos mutantes afectados tanto en la síntesis como en la degradación de este polisacárido, se analiza que influencia tienen sobre la capacidad fotosintética celular y como se redistribuye el carbono según el punto de afectación del proceso. Estamos interesados en el efecto que tiene la producción de gránulos de glucógeno de estructura aberrante en la viabilidad celular. Además de identificar aquellas proteínas que estén directamente asociadas al gránulo que puedan tener un papel regulador en la dinámica de este. Por otra parte, en mutantes afectados en la síntesis de glucógeno el metabolismo de la glucosa, añadida externamente, produce alteraciones metabólicas que afectan tanto al proceso fotosintético como a la viabilidad celular. Pretendemos conocer cuáles son los mecanismos que provocan dicha interferencia.
3. Estado redox celular y metabolismo fotosintético.
En esta línea se estudia una amplia colección de mutantes afectados en el sistema redox FTR-Trx, (Ferredoxina tiorredoxina reductasa-Tiorredoxina). Con respecto a las Trx, los resultados previos obtenidos indican claramente que la tiorredoxina más abundante de las cianobacterias, TrxA (equivalente a la tiorredoxina m de plantas) es esencial. El análisis detallado de un mutante de TrxA condicional nos está permitiendo dilucidar sus múltiples funciones, entre las que destaca su interacción con la maquinaria traduccional. Estamos interesados en el análisis de los mutantes en diferentes condiciones nutricionales (diferentes concentraciones de CO2 y fuentes de nitrógeno). Mediante estudios metabólicos pretendemos definir su papel además en el control del Ciclo de Calvin y en la distribución tanto de azúcares, como de aminoácidos en función del nivel de TrxA. Un objetivo dentro de esta línea es la caracterización de los mutantes en la reductasa (FTR), disponemos ya de mutantes condicionales, que presentan un carácter pleiotrópico como ocurre con los mutantes en TrxA. Se espera una incidencia mayor en la viabilidad celular en estos mutantes ya que deben alterar radicalmente el estado redox global.
4. Papel del exosoma en la adaptación al estrés ambiental.
Las cianobacterias son capaces de excretar al medio de cultivo metabolitos, proteínas y ácidos nucleicos, como hemos podido analizar con diversos mutantes de afectación metabólica indicados en las líneas anteriores. Pretendemos conocer con detalle, cómo y cuándo se excretan estos compuestos y si muchos de estos compuestos tienen una correlación con las condiciones ambientales en las que se encuentra el cultivo. Además, estudios previos en colaboración con otros grupos de investigación sugieren que Synechocystis es capaz de formar vesículas extracelulares que pueden tener un papel relevante en la homeostasis frente a metales. Conocer las condiciones en las que estas vesículas se producen y la naturaleza de su contenido puede ayudarnos a entender el papel que juegan en la adaptación a las condiciones ambientales de estos organismos.

| Nombre | Apellidos | Categoria | Teléfonos | |
|---|---|---|---|---|
| Sandra | Díaz Troya | Profesora Contratada Doctora | 954139180 ext. 446068 |
|
| Francisco J. | Florencio Bellido | Catedrático US | 954489509 ext. 446009 |
|
| Joaquín | Giner Lamia | Profesor Contratado Doctor | 954489601 ext. 446003 |
|
| M. José | Huertas Romera | Profesora Titular US | 954489601 ext. 446003 |
|
| M. Isabel | Muro Pastor | Científica Titular CSIC | 954489598 ext. 446098 |
|
| Pablo | Ortega Martínez | Investigador Predoctoral | 954139180 ext. 446068 |
-
Ortega-Martínez P, Nikkanen L, T. Wey L, Florencio FJ, Allahverdiyeva Y, Díaz-Troya S. Glycogen synthesis prevents metabolic imbalance and disruption of photosynthetic electron transport from photosystem II during transition to photomixotrophy in Synechocystis sp. PCC 6803. New Phytologist 2024. En prensa.
-
Mallén-Ponce MJ, Florencio FJ, Huertas MJ. Thioredoxin A regulates protein synthesis to maintain carbon and nitrogen partitioning in cyanobacteria. Plant Physiol. 2024 Feb 22:kiae101. doi: 10.1093/plphys/kiae101.
-
Domínguez-Lobo MT, Roldán M, Gutiérrez-Diánez AM, Florencio FJ, Muro-Pastor MI. Double blocking of carbon metabolism causes a large increase of Calvin-Benson cycle compounds in cyanobacteria. Plant Physiol. 2024 Feb 20:kiae083. doi: 10.1093/plphys/kiae083.
-
Ortega-Martínez P, Roldán M, Díaz-Troya S, Florencio FJ. Stress response requires an efficient connection between glycogen and central carbon metabolism by phosphoglucomutases in cyanobacteria. J Exp Bot. 2023 Mar 13;74(5):1532-1550. doi: 10.1093/jxb/erac474. PMID: 36454663; PMCID: PMC10010611.
- Lima S, Matinha-Cardoso J, Giner-Lamia J, Couto N, Pacheco CC, Florencio FJ, Wright PC, Tamagnini P, Oliveira P. Extracellular vesicles as an alternative copper-secretion mechanism in bacteria. J Hazard Mater. 2022 Jun 5;431:128594. doi: 10.1016/j.jhazmat.2022.128594. Epub 2022 Feb 26. PMID: 35259694.
-
Mallén-Ponce MJ, Huertas MJ, Sánchez-Riego AM, Florencio FJ. Depletion of m-type thioredoxin impairs photosynthesis, carbon fixation, and oxidative stress in cyanobacteria. Plant Physiol. 2021 Nov 3;187(3):1325-1340. doi: 10.1093/plphys/kiab321. PMID: 34618018; PMCID: PMC8566235.
-
Bolay P, Rozbeh R, Muro-Pastor MI, Timm S, Hagemann M, Florencio FJ, Forchhammer K, Klähn S. The Novel PII-Interacting Protein PirA Controls Flux into the Cyanobacterial Ornithine-Ammonia Cycle. mBio. 2021 Mar 23;12(2):e00229-21. doi: 10.1128/mBio.00229-21. PMID: 33758091; PMCID: PMC8092223.
-
García-Cañas R, Giner-Lamia J, Florencio FJ, López-Maury L. A protease-mediated mechanism regulates the cytochrome c6/plastocyanin switch in Synechocystis sp. PCC 6803. Proc Natl Acad Sci U S A. 2021 Feb 2;118(5):e2017898118. doi: 10.1073/pnas.2017898118. PMID: 33495331; PMCID: PMC7865156.
-
Muro-Pastor MI, Cutillas-Farray Á, Pérez-Rodríguez L, Pérez-Saavedra J, Vega-de Armas A, Paredes A, Robles-Rengel R, Florencio FJ. CfrA, a Novel Carbon Flow Regulator, Adapts Carbon Metabolism to Nitrogen Deficiency in Cyanobacteria. Plant Physiol. 2020 Dec;184(4):1792-1810. doi: 10.1104/pp.20.00802. Epub 2020 Sep 8. PMID: 32900980; PMCID: PMC7723081.
-
Robles-Rengel R, Florencio FJ, Muro-Pastor MI. Redox interference in nitrogen status via oxidative stress is mediated by 2-oxoglutarate in cyanobacteria. New Phytol. 2019 Oct;224(1):216-228. doi: 10.1111/nph.15979. Epub 2019 Jul 2. PMID: 31168850.


